TRAEC 1.1版本评估流程
Step 1: Problem Formulation
1.1. 我们聚焦于在环境和人群中可以准确测量的,存在较高检出率并且当前未控制的一些环境暴露因素,例如农药、全氟化学物、重金属等。
1.2 关注当前发病率高、测量结果真实可靠,并且对人体具有潜在健康风险的不良健康结局,例如慢阻肺、糖尿病、肥胖、脂肪肝病、职业病等。
1.3. 针对特定化学物的潜在靶标健康风险构建科学的问题架构,例如“孕期阿特拉津暴露与后代的神经发育之间的关系是什么”。
Step 2: Evidence Collection
2.1. 证据收集包括现有及新开展的证据,并且全面结合各种类型的研究数据,这也是与传统风险评估相比的最大区别。
2.2. 研究人员需要查阅现有研究,包括已发表的流行病学、体内和体外研究的相关结果。通过整合不同来源的数据(如文献数据库、权威机构和官方网站)获得。
(1)确定证据选择标准:
明确证据收集的类型:流行病学、体内研究、体外研究等
明确证据收集的内容:收集全球关于该方向的研究资料
明确证据收集的时间范围
明确证据检索策略:
确定检索数据库(PubMed、Web of Science、ScienceDirect等)
确定暴露和结局的检索关键词(通过MeSH确定主题词、副主题词、自由词)
确定所有数据库的相关检索式
检索相关证据:
双人独立执行相同检索,筛选及汇总证据,确保选择过程中无偏移
若遇到分歧时与第三名高等级研究者讨论
对研究证据进行纳入排除:
对检索到的无关内容,初筛时根据摘要和分类将Meta、Review、Conference abstracts、Case reports、Guidelines等进行排除,复筛时对文献内容进行详细阅读,对无法提取到相关数据以及无关的内容进行排除,例如:
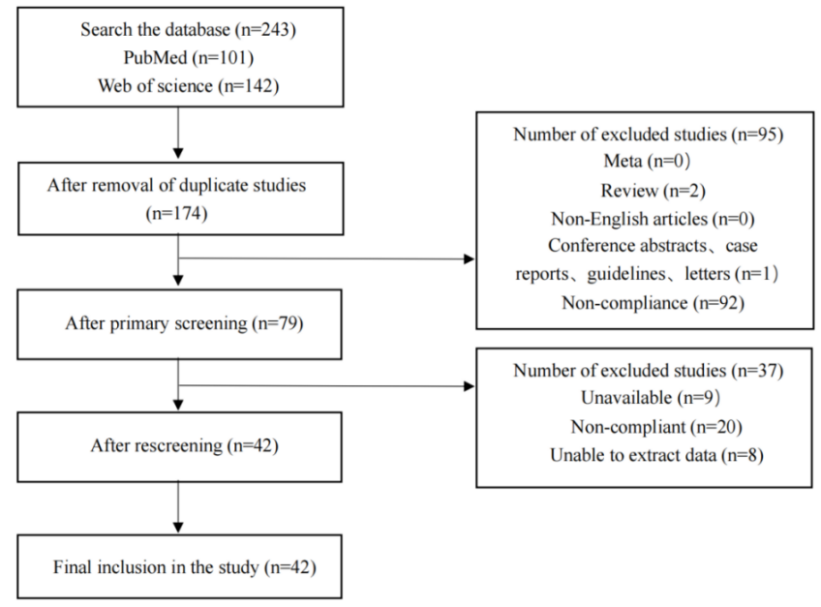
汇总所有研究结果:
按照研究类型整理和分析所有研究结果,并以清晰的形式呈现出来,他们应该至少包含:文献代码、研究对象、暴露或检测方式、研究结果、研究结论、效应浓度等,例如:
1. 流行病学研究
PMID | Experimental Subject | Exposure Mode | Research Results | Conclusion | Concentration |
36809709 | 710 pregnant women in the second trimester were randomly recruited | A total of 49 pesticides were measured simultaneously using gas chromatography-triple quadrupole tandem mass spectrometry (GC–MS/MS). They assessed neuropsychological development in children using the Ages and Stages Questionnaire (ASQ), Third Edition. | Prenatal exposure to pesticides might adversely alter child neurodevelopment. | Developmental neurotoxicity associated with prenatal exposure to pesticide | Atrazine (serum) LOD:0.05ng/ml GMD:1.04ng/ml |
2. 体内研究
PMID | Experimental Subject | Exposure Mode | Research Results | Conclusion | Effect Concentration |
28027470 | Male quail chicks (Coturnix C. coturnix), aged 18 days with an average weight of 86.7 ± 6.4 g | 50 mg/kg, 250 mg/kg and 500 mg/kg atrazine were administered once a day orally by gavage for 45 days. | Atrazine enhanced the activities of cerebellar CYP450s and increased the contents of CYP450 in quails. The cerebellar PXR/CAR pathway responses were activated by exposing to atrazine. | Atrazine exposure induced cerebellar toxicity. | 50, 250, 500 mg/kg |
3. 体内研究
PMID | Experimental Subject | Exposure Mode | Research Results | Conclusion | Effect Concentration |
34146662 | hESC-H9 cell line (WA09, WiCell Research Institute, USA) | NSCs were exposed to 100 μM atrazine, starting from 1 DIV for either 5, 10 or 15 days (DIV 5, 10, 15), total medium change containing 100 μM atrazine was performed twice a week. | The dopaminergic system was not the only target of atrazine neurotoxicity, glutamatergic neurons and astrocytes were also adversely affected. | Atrazine not only inhibited proliferation and induced cell cycle arrest but curbed early neural differentiation.. | 300, 500 μM |
三、对于未阐明的机制,研究人员可自行开展流行病学、体内和体外研究,以验证和补充文献证据,包括机体对暴露于目标化学物的反应、分子起始事件、细胞反应或细胞表型等。
四、与传统风险评估的最大区别:可包含新开展研究。
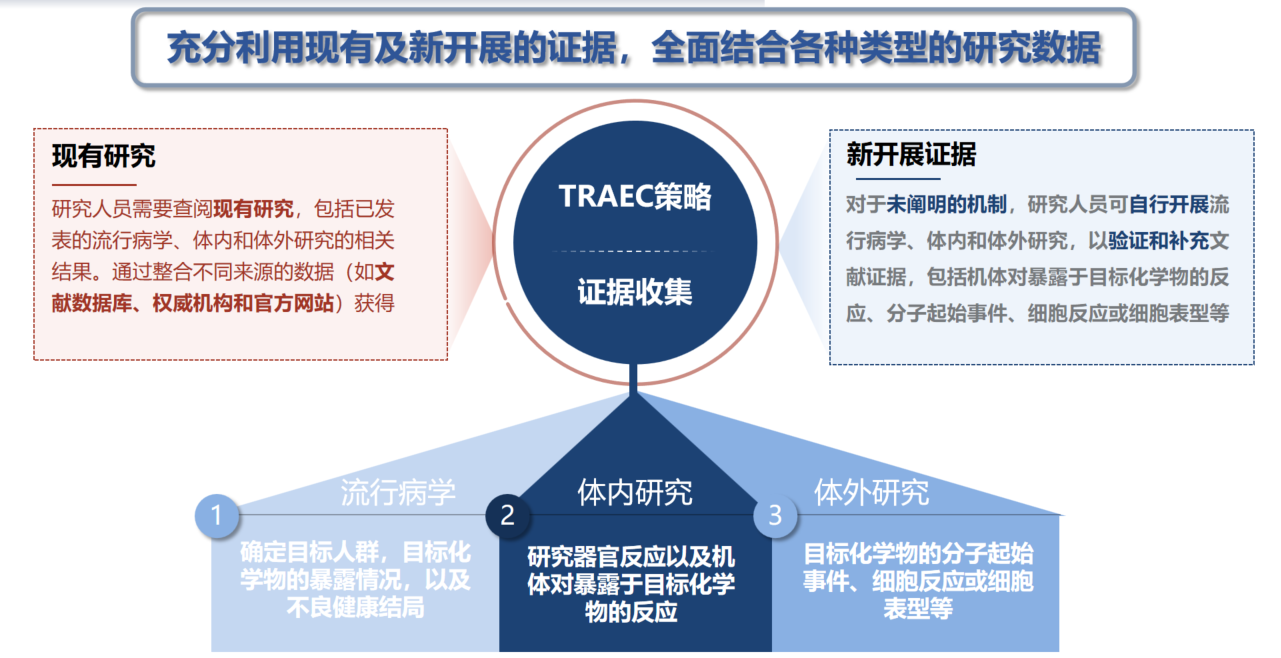
TRAEC策略证据收集示意图
Step 3: Evidence Scoring & Conclusion
环境化学物的风险评估需要对现有研究证据进行综合评估,这些证据包括流行病学研究、体内和体外研究。对于个别研究人员来说,如何以系统、透明和一致的方式评估全面的证据,以获得高可靠性的结论仍然难以捉摸。因此,制定《综合证据评分规则》就是为了应对这些挑战。
数据来源多种多样,如数据库、权威机构和研究人员实验室。该框架可通过整合四个关键部分来评估健康风险,包括可靠性得分、浓度权重、相关性得分和完整性得分。将不同证据的得分根据公式求和计算,得出证据的总体有效性、关联的方向和强度。
评分系统
TRAEC策略的评分系统分为四个部分:第一部分:可靠性得分 Reliability Scores;第二部分:浓度权重Weight of Concentrations;第三部分:相关性Correlation Scores;第四部分:完整性Integrity Scores。
可靠性得分 Reliability Scores
可靠性用于衡量实验设计和实施的质量,分别对流行病学/体内/体外研究设计和实施的可靠性进行评分,在下述描述中,它们可被认为是0分(无相关条件),0.5分(符合部分条件)以及1分(满足全部条件)。
1. 流行病学研究Epidemiological studies
Participants and sample size研究对象与样本量 |
1. Are the fundamental demographic characteristics of the study participants adequately documented, including but not limited to age, gender, and BMI? 研究对象的基本信息是否充分,如年龄、性别和BMI等? |
2. Is the sample size of the study adequate and reasonable? 研究样本量是否充分且合理? |
Study design研究设计 |
3. Is the study design appropriate for the characteristics of the test chemical? For example, the selection of the exposed population, time, and mode. 设计方案是否适合试验化学物的特点?例如选取的暴露人群、时间和模式。 |
4. Has a control group been included, such as positive control, negative control, crossover control, or self-control? 是否纳入对照组,如阳性对照、阴性对照、交叉对照或自身对照? |
Data collection and analysis数据收集和分析 |
5. Is the detection or assessment of exposure assessment scientifically appropriate? 暴露检测或评估的方法是否科学恰当? |
6. Are the study endpoint(s) and their method(s) of determination clearly described? 是否明确描述研究终点及其测定方法? |
Plausibility of data数据合理性 |
7. Are the statistical methods for data analysis provided and applied in an appropriate, transparent manner? 是否适当且透明的提供与使用了数据分析的统计方法? |
8. Is the description of the study results thorough and transparent? 是否清晰和完整的描述了研究结果? |
Bias偏倚 |
9. Baseline data for both included and excluded populations, as well as high and low exposure groups, are well-balanced, comparable, and adjusted for significant confounding factors. 纳入/排除人群以及高/低暴露组的基线数据均衡可比,并控制重要混杂因素。 |
10. Descriptions that reflect the quality control in the implementation process are included, such as on-site supervision, quality control of samples or questionnaires, etc. 描述实施过程的质量控制措施,如现场监督、样品或问卷的质量控制措施等。 |
2. 体内研究In vivo studies
Test compound试验化学物 |
1. Is the chemical name, source and the purity, of the test compound given? 是否提供试验化学物的化学名称,来源以及纯度? |
2. Is there an appropriate solvent (vehicle) used? For example, it does not interfere with the study results at the concentration used, and a solvent (vehicle) control is incorporated. 是否使用合适的溶剂(载体)?其在试验浓度下不会干扰结果,并加入溶剂(载体)对照。 |
Animal model动物模型 |
3. Is the animal model used for investigating the test compound and selected endpoints reliable and sensitive? 用于研究试验化学物和选定终点的动物模型是否可靠和敏感? |
4. Is the animal model described, such as species, strain, age or life stage and sex? 是否描述动物模型的物种、品系、年龄或生命阶段和性别? |
Dosing and administration of the test compound试验化学物的剂量和染毒 |
5. Is there a reasonable exposure mode stated? For example, it includes a clear explanation of duration, dosage, and routes of exposure, etc.. 是否有合理的染毒模式?对染毒时间、剂量和途径均有明确解释。 |
6. Are the method for allocating animals to different treatments and the total number of animals per dose group specified? 是否规定将动物分配到不同染毒组的方法和每个剂量组的动物总数? |
Data collection and analysis数据收集与分析 |
7. Are the test and/or analytical methods used sufficiently described to allow for evaluation of the reliability of results? 是否充分描述所使用的测试和分析方法,以评估结果的可靠性? |
8. Are the method for allocating animals to different treatments and the total number of animals per dose group specified? 是否规定将动物分配到不同染毒组的方法和每个剂量组的动物总数? |
Bias偏倚 |
9. Are experimental conditions consistent across all study groups? 各研究组的实验条件是否相同? |
10. Can we trust the outcome assessment? 结果评估方法是否可靠? |
3. 体外研究In vitro studies
Test compound试验化学物 |
1. Is the chemical name, source and the purity, of the test compound given? 是否提供试验化学物的化学名称,来源以及纯度? |
2. Is there an appropriate solvent (vehicle) used? For example, it does not interfere with the study results at the concentration used, and a solvent (vehicle) control is incorporated. 是否使用合适的溶剂(载体)?其在试验浓度下不会干扰结果,并加入溶剂(载体)对照。 |
Test System动物模型 |
3. Is there a dependable and sensitive test system (e.g., cell line/cells /tissue /organ/ embryo/sub-cellular fractions) with metabolic capability, where applicable, utilized to investigate the test compound and endpoints? 在适用的情况下,是否有可靠和灵敏的具有代谢能力的测试系统用于研究试验化学物和终点?(例如细胞系/细胞/组织/器官/胚胎/亚细胞组分) |
4. Are the conditions for culturing and/or maintaining the cell line/ cells/ tissue/ organ/embryo/sub-cellular fractions (including temperature, humidity, CO2 levels, media formulation, number of passages, and contamination control) adequate? 培养和维持细胞系/细胞/组织/器官/胚胎/亚细胞组分的条件是否合适?(包括温度、湿度、CO2浓度、培养基配方、传代次数和避免污染) |
Administration of the test compound试验化学物的剂量和染毒 |
5. Are the duration of exposure and the concentrations used suitable for the test system and investigated endpoints? 染毒时间和浓度是否适合测试系统和研究终点? |
6. Are the test conditions during and after exposure to the test compound suitable, such as media and serum used, cell density, incubation temperature, humidity, CO2 concentration? 暴露于试验化学物期间和之后的条件是否合适,例如使用的培养基、血清、细胞密度、培养温度、湿度和CO2浓度? |
Data collection and analysis数据收集与分析 |
7. Are reliable and sensitive tests and/or analytical methods used for investigating the endpoints? 是否使用可靠和敏感的测试和分析方法来调查终点? |
8. Are the statistical methods clearly described and do not appear inappropriate, unusual or unfamiliar? 是否描述清楚统计方法,没有不恰当、不寻常或不熟悉的内容? |
Bias偏倚 |
9. Are experimental conditions consistent across all study groups? 各研究组的实验条件是否相同? |
10. Can we trust the outcome assessment? 结果评估方法是否可靠? |
二:浓度权重Correlation Scores, ε
受试物工作浓度是影响其毒性效应的重要影响因素,多数时候,我们不希望毒性证据来自于高浓度暴露。在实践中,不同研究间靶标化学物浓度差异巨大。因此,我们需要建立一个基于浓度的校正权重,即:
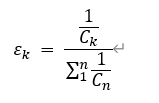
需要注意的是,不同研究类型、染毒方式的暴露浓度具有多种描述形式,例如:
在流行病学研究中,基于生物样本的暴露评估为内暴露浓度,基于血清/血浆/全血的暴露浓度与基于尿液、毛发等的暴露浓度应当进行换算。
在体内研究中,啮齿类模型的口服、饮水染毒为外暴露浓度,注射染毒为内暴露浓度;此外,不同种属间暴露浓度应当进行换算。
在体外研究中,基于培养基的细胞染毒通常被视为内暴露浓度,摩尔质量浓度与质量浓度应当进行换算。
通过计算机模拟,在可靠度评分均值等于4,6,8分,方差为2分的评分中,随着不同研究的浓度差异增加,对其最终评分的影响如下:
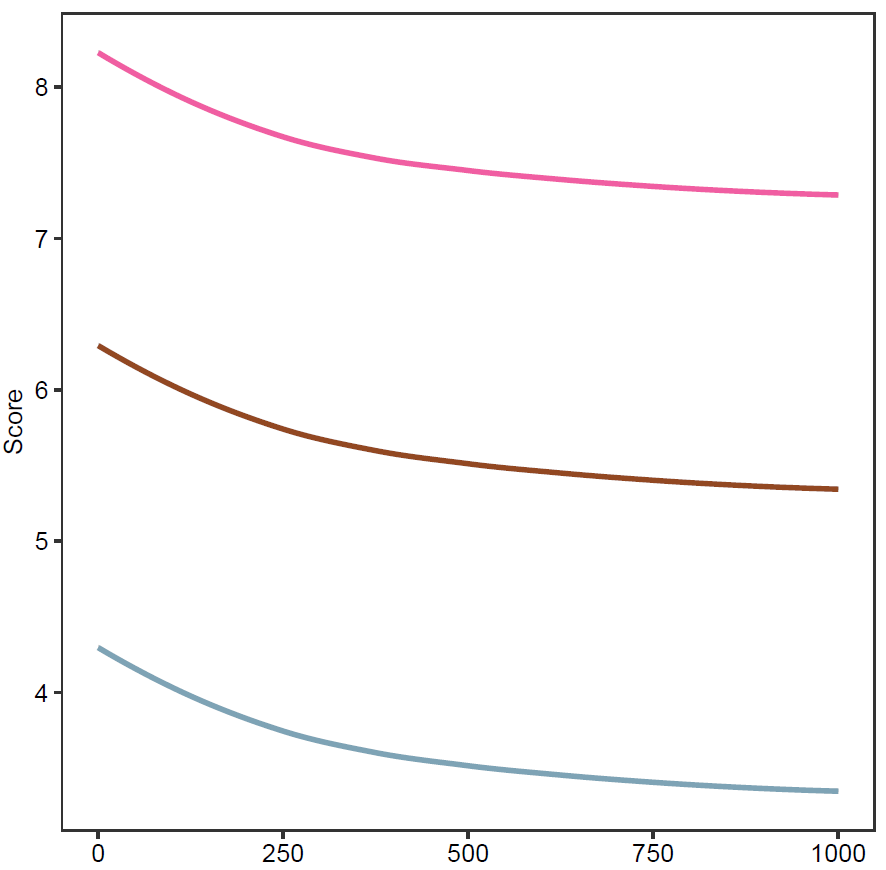
三:证据强度Risk intensity.
证据强度反映了暴露导致结果的程度。在流行病学、体内与体外研究中分别指:
流行病学:
1.1 分:暴露与结局的风险强度(RR/OR/HR):(0,0.5]或[2, +∞);
2. 0.8 分:暴露与结局的风险强度(RR/OR/HR):(0.5,1]或[1, 2);
3. 0.4 分:暴露与结局的风险强度(RR/OR/HR)P ≥ 0.05。
体内实验:
1. 1分:表型、分子/细胞水平均提示变化;
2. 0.8分:仅出现表型、分子/细胞水平变化。
3.0.4 分:无表型、分子/细胞水平变化
体外实验:
1. 1分:表型、分子/细胞水平均提示变化;
2. 0.8分:仅出现表型、分子/细胞水平变化。
3. 0.4 分:无表型、分子/细胞水平变化
四:相关性Correlation Scores.
相关性反映了暴露和结果之间的关联方向,分为正和负相关。
研究类型 | 分数 | 关联方向 |
流行病学/体内/体外研究 | 1分 | 正相关 |
0分 | 无显著相关 | |
-1分 | 负相关 |
五:完整性Integrity Scores.
完整性是指各类证据的综合程度,完整的证据包括流行病学、体内和体外实验。
研究类型 | 评分标准 | 分数 |
流行病学/体内/体外研究 | 包含任意一个 | *1/3 |
包含任意两个 | *2/3 | |
全部包含 | *1 |
六:综合证据得分:

ω……………………………………………………………………………………………………………Reliability Scores
Ɛ………………………………………………………………………………………………………..Weight of Concentrations
r……………………………………………………………………………………………………………Correlation Scores
I……………………………………………………………………………………………………………Integrity Scores
C…………………………………………………………………………………………………………..Lowest Concentration of Effects
n………………………………………………………………………………………………………….Number of studies of a single part
i………………………………………………………………………………………………………….. Number of All studies
七:风险界值的划分:
上述综合证据得分提供了一种透明的方式,可以将复杂的研究结果整合为定量得分,作为支持结论的基础。我们将目标化学物的健康风险分为低、中或高:(0,4]为低水平风险,(4,8]为中等水平风险,和(8-10)为高水平风险;(0,-4]为低水平保护,(-4,-8]为中等水平保护,和(-8,-10]为高水平保护。

注意事项
一、研究小组在使用TRAEC策略进行环境化学物风险评估的过程中,要有效参与、分工合作,包括在制定研究问题,收集检索证据,以及评分时均要注意双人进行,遇到分歧与研究小组讨论,使结果更加可靠。
二、评分系统使用注意事项:
(一)不同类型研究分开评分,Reliability Scores相差2分以上需要由另一名研究人员仲裁;
(二)不同染毒模型、染毒剂量单位,需要对浓度进行换算,统一至相同模型与相同单位。
(三)Correlation Scores对于不同研究结果之间的差异性可以进行抵消;
(四)Integrity Scores是在计算平均证据得分后再计算证据链的完整性;
(五)Number of evidence是证据的数量,不是文献的数量,同一篇文献可能存在多个类型的研究证据;
(六)Comprehensive evidence score对于每项单独的研究是reliability,weight of concentration, correlation三部分的乘积,对所有研究的得分汇总;
(七)研究者需对所有纳入文献证据(包括自身的已发表数据)进行标准引用。


